Produits de Maillard et facteurs nutritionnels
Généralités
Pour le mammifère, il existe des acides aminés essentiels qui doivent être obligatoirement apportés par le biais de son alimentation. Le fait que ces acides aminés sont susceptibles de réagir avec des fonctions carbonylées doit être pris en considération dans l'élaboration d'une ration alimentaire et a fortiori dans l'établissement d'un procédé de fabrication. Il est nécessaire dans un premier temps de connaître quel sera le taux de ces acides aminés disponibles par rapport à ce qu'on peut effectivement doser et dans un deuxième temps de savoir si les produits de la réaction de Maillard obtenus sont susceptibles ou non d'être assimilés par le tractus digestif.
Comme la lysine est un des acides aminés les plus réactif vis-à-vis de la réaction de Maillard, on effectue le dosage de la lysine disponible par un dosage simple au fluoro-dinitrobenzène, selon le schéma explicité ci-après.
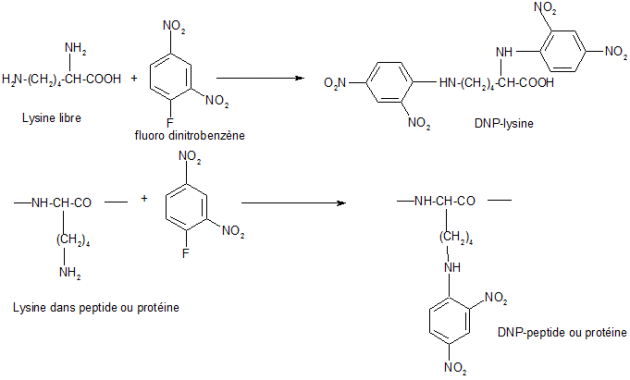
Explications
On remarque par exemple que le séchage du lait se traduit par une perte de lysine disponible de l'ordre de 14%. Cette perte résulte de l'interaction avec le lactose qui se continue dans le temps ; perte de 15,5% après 6 mois de stockage à température ambiante et de 17,5% après 18 mois. La réaction de Maillard est augmentée si le lactose cristallise.
Explication
Il n'y a pas que la lysine qui subit la réaction de Maillard comme le montre les expérimentations suivantes dans le cadre de la chair de poisson chauffée en présence de glucose à 116°C ou de la caséine traitée à 37°C sous HRE constante (70%) pendant 5 et 30 jours en présence de glucose.
Explication
Dans cette deuxième expérience, le tryptophane, l'acide glutamique ou la phénylalanine ne sont pas touchés.
Le fumage des saucisses par fumée froide entraîne une perte de 12% de lysine en 24 à 48 heures. Quand on opère à des températures plus importantes, il y a augmentation de la perte en lysine sans jamais dépasser 20%.
En panification on observe une diminution du taux des fonctions carbonylées qui va de paire avec la diminution des acides aminés dosables. Si le taux d'acides aminés libres est de 103 µmoles pour 100g de farine, celui-ci est de 184 µmoles pour la pâte (après le pétrissage), 184 µmoles pour la mie et seulement 10 µmoles pour la croûte.On remarque aussi une différence de teneur en ces molécules entre la croûte et la mie.
Si on étudie l'évolution de quelques acides aminés entre la pâte et la croûte, on met en évidence les variations suivantes
Voir tableau :
Evolution des acides aminés libres dans le pain
La réaction de Maillard continue d'évoluer en fonction du temps.
Voir tableau :
Evolution de la teneur en produits carbonylé au cours du rassissement du pain
Dans le cas où ces acides aminés sont bloqués il est possible de récupérer, dans les premiers stades de la réaction de Maillard, l'acide aminé par une hydrolyse acide. Cette réaction est possible in vitro mais ne se déroule pas in vivo car on retrouve les dérivés bloqués des acides aminés dans les urines et les fèces.
Fondamental :
Ceci prouve que les composés ne sont pas métabolisés ni au niveau du tractus digestif ni par la microflore intestinale. Dans le cas de la lysine, les composés obtenus sont soit la furosine ou la pyridosine
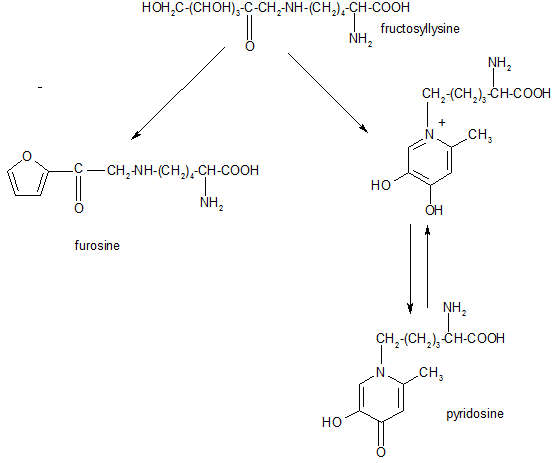
Généralités
Les industriels se sont posés la question suivante : comment peut on éviter la condensation de la lysine avec des fonctions carbonylées afin de prévenir de possibles carences alimentaires en lysine ? On a vu lors de l'étude des paramètres modulant la réactivité de la réaction de Maillard que cette dernière était maximale si la fonction amine primaire était libre.
Fondamental :
Différentes études ont été réalisées en acylant la fonction amine libre. Cette opération est possible car il existe au niveau de la muqueuse intestinale une enzyme l'aminoacyl acylase (EC 3.5.1.14) qui est capable de déacyler les structures selon le mécanisme suivant à la condition que les acides aminés soient de la série L :
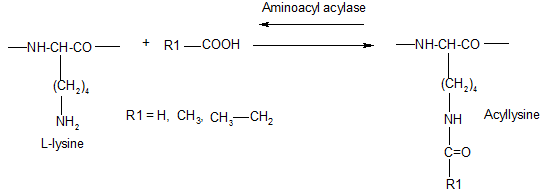
Explication
Il est possible de mettre en évidence que la formylation et l'acétylation de la lysine donnent des dérivés qui sont hydrolysés par l'enzyme de la muqueuse intestinale que ce soit au niveau de la lysine libre ou de la lysine engagée dans une structure peptidique ou protéique. Dans le cas de l'acétylation, la récupération n'est pas totale et on peut caractériser les produits de condensation dans les fèces et les urines. Par contre la propionylation ne permet de récupérer en aucune manière la lysine à partir du propionyllysine. On dispose à ce niveau d'un moyen pour prévenir ou surtout diminuer les risques de blocage de la lysine lors de l'application d'un procédé de fabrication mettant en jeu des protéines et des saccharides.
Généralités
La réaction de Maillard peut évidemment se réaliser avec des molécules très importantes que sont les vitamines. Ainsi les tocophérols (vitamine E) vont donner de la réaction de Maillard et des produits de la réaction de dégradation de Strecker. La thiamine (vitamine B1), le pyridoxale, la pyridoxine, la pyridoxamine (vitamine B6) donnent de la réaction de Maillard ainsi que l'acide folique (vitamine B9), la cyanocobalamine (vitamine B12) et l‘acide p-aminobenzoique. Ces réactions peuvent engendrer de ce fait des carences au niveau physiologique.
Les aldosylamines et les cétosylamines se sont avérées être, in vitro, des inhibiteurs puissants de la trypsine pancréatique. In vivo l'action des produits de la réaction de Maillard est moins nette car d'autres systèmes protéolytiques peuvent agir afin de dégrader les protéines du bol alimentaire. Dans le cas particulier de l'utilisation des farines de graines de coton, c'est le gossypol qui donnera des complexes avec la lysine. Les mélanoïdines obtenues sont des inhibiteurs compétitifs (Ki = 50µM) de l'activation du pepsinogène en pepsine. Enfin les prémélanoïdines, à forte concentration (> à 1,5% P/P), sont d'une façon générale des inhibiteurs de la pyruvate décarboxylase.






