Propriétés émulsifiantes
Définition :
Une émulsion est une dispersion de deux liquides non miscibles sous la forme de fines gouttelettes (0,1 à 50 µm de diamètre) de l'un des liquides dans l'autre.
Il existe de ce fait ce qu'on appelle une phase dispersée (discontinue) et une phase dispersante (continue). Il existe deux types d'émulsion
émulsion de gouttelette d'huile dans l'eau : O/W (Oil/Water) : coloration blanchâtre, aspect crémeux,
émulsion de gouttelette d'eau dans de l'huile : W/O (Water/Oil) : couleur foncée, aspect gras.
Lorsqu'on mélange de l'huile dans de l'eau et que le rapport O/W est inférieur ou égal à 0,74 on est en présence d'une émulsion huile dans eau (mayonnaise par exemple). Au delà de 0,74 il y a une inversion de phase et on est en présence d'une émulsion eau dans huile (cas du beurre, de la margarine).
La formation d'une émulsion entraîne une augmentation de la surface interfaciale entre les gouttelettes de liquide non miscible. Cette augmentation est d'autant plus importante que la taille des gouttelettes est plus petite. L'émulsion d'un volume équivalent de 1mL d'huile sous la forme de gouttelettes de 1 µm de diamètre va donner 2 1012 gouttelettes développant une surface de l'ordre de 6 m2. Une surface interfaciale importante nécessite un apport d'énergie libre important pour être stabilisée. L'énergie doit être proportionnelle à la surface et à la tension superficielle.
Remarque :
Tout liquide pris séparément à tendance à réduire autant que possible sa surface de contact avec l'air ou un autre liquide non miscible ce qui à terme entraîne une déstabilisation de l'émulsion. Cette déstabilisation peut être caractérisée par les phénomènes suivants :
un crémage qui est une séparation des gouttelettes de la phase dispersante due à la différence de densité (il y a remontée ou sédimentation de l'une des phases). Ce phénomène répond à la loi de Stokes qui traduit le déplacement d'une gouttelette isolée par la relation suivante :
Vitesse de migration
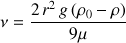
Où : r représente le rayon de la gouttelette, g l'accélération de la pesanteur,
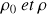 la densité de la phase continu et la densité de la phase dispersée,
la densité de la phase continu et la densité de la phase dispersée,
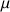 le coefficient de viscosité de la phase continue.
le coefficient de viscosité de la phase continue.une floculation qui est une association réversible des gouttelettes les unes aux autres due à la suppression des charges de surface des gouttelettes (à partir d'une certaine taille les flocs entraînent le crémage). Ce phénomène est réversible car les forces qui le régissent sont faibles,
une coalescence qui est due à une fusion des gouttelettes par rupture du film interfacial. La taille des gouttelettes augmente et leur nombre diminue dans la phase continue. Ceci entraîne une séparation de phase par crémage. Ce phénomène est irréversible.
Les facteurs qui favorisent la déstabilisation des émulsions sont la centrifugation, les chocs thermiques.
Une émulsion sera stabilisée de la façon suivante :
une tension interfaciale faible,
une couche interfaciale résistante,
une identité de charge en surface,
un faible diamètre des gouttelettes,
une forte viscosité du milieu.
Dans le cas des émulsions alimentaires de type huile dans eau la qualité des protéines présentes dans le milieu permet dans certains cas une stabilisation de l'émulsion. Par contre dans le cas d'une émulsion eau dans huile, il n'y a pas la présence de ces macromolécules, la stabilisation est due, alors, à la structure solide cristalline à température ambiante de la phase dispersante qui est la matière grasse. Pour obtenir une homogénéisation stable entre la phase dispersée et la phase continue, les industries alimentaires vont utiliser des émulsifiants.






