La glycinine
C'est une globuline 11S représentant 40% des protéines. Sa masse moléculaire avoisine 320 – 350 KDa, elle est constituée de 12 sous-unités (6 sous-unités à caractère acide (A, 40 KDa) et 6 sous-unités à caractère basique (B, 20 KDa). Chaque sous-unité basique est entourée de 3 sous-unités de charge opposée, les sous-unités sont reliées par des ponts disulfure, la molécule se présente sous la forme de 2 structures hexagonales empilées. La molécule est relativement hydrophobe.
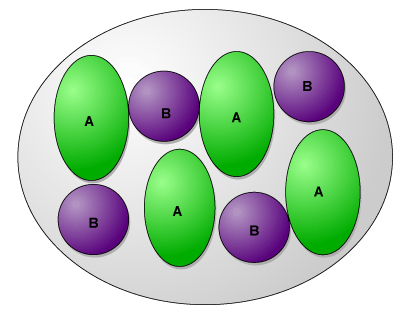
La glycinine renferme 42 à 46 atomes de soufre qui se trouvent impliqués pour la majorité d'entre eux dans la formation de ponts disulfure. Quelques rares atomes de soufre se retrouvent dans des fonctions thiol libres. La glycinine est facilement dissociée en sous-unités à faible force ionique (µ=0,01) à pH acide ou alcalin, par chauffage entre 80°-92°C ou en présence d'agents chaotropiques. A force ionique importante (NaCl 0,5 à 2M), il y a renforcement de la structure quaternaire par interaction hydrophobe ou diminution des forces de répulsion par neutralisation des charges.
La température qui provoque la dénaturation entraîne en plus soit la dissociation soit l'agrégation de la macromolécule.
Ainsi à pH 7-7,6, à 100°C et à une force ionique de l'ordre de 0,2 à 0,4 il y a dissociation suivie d'agrégation.
Après dissociation les sous-unités vont se réarranger par des interactions hydrophobes qui sont supérieures aux forces de répulsion électrostatique. Les sous-unités basiques vont s'associer les unes aux autres par échange de pont disulfure. Cette association s'effectue entre les sous-unités d'une même molécule. L'ensemble est maintenu en solution par la présence des sous-unités acides. Les sous-unités acides sont libérées par échange de pont disulfure et restent en solution (répulsion due aux charges négatives). Les polymères de sous-unités basiques dont la taille peut atteindre 107 Da vont s'associer entre elles et former des agrégats par interaction hydrophobe puis précipiter. Quand la concentration en protéine est faible il y a peu de chance d'obtenir l'agrégation ou la polymérisation.
Le comportement de la glycinine est différent en présence de β conglycinine. Dans les conditions de dissociation de la glycinine et en présence de la β conglycinine il y a association électrostatique entre les sous-unités basiques de la glycinine avec les sous-unités acides de la β conglycinine. Cela forme un complexe soluble dont la charge globale est négative.
Si on augmente la force ionique (µ > 0,5) par addition de sel (NaCl) on provoque un recul d'ionisation. Les sous-unités basiques libérées de leur interaction vont s'associer entre elles et donner des agrégats. Les sous-unités de la β conglycinine vont rester en solution.
La force ionique possède un comportement antagoniste sur la glycinine :
Elle favorise l'agrégation des sous-unités dissociées
Elle favorise la structure quaternaire de la molécule native
Les protéines de soja ont la particularité de pouvoir gélifier. Une solution de protéine de concentration supérieure à 5% (P/V) lorsqu'elle est chauffée à un pH voisin de la neutralité donne un gel. La solution passe dans un premier temps par un liquide à viscosité accrue : le progel. A faible force ionique, la gélification commence vers 70°C et doit correspondre au déplissement de la β conglycinine. A force ionique élevée et à température plus élevée cet état correspond à un équilibre entre interaction eau/protéine et protéine/protéine.
La fermeté des gels varie avec la valeur de la force ionique et en fonction de la sévérité du traitement thermique. Avec une solution de protéine à 10% (P/V) le gel présente une texture ferme à 80°C et une texture faible à 120°C. Dans ce dernier cas, ceci est du à la rupture des liaisons intra et intermoléculaires. D'un point de vue pratique, les gels de soja ne supportent pas la stérilisation.
Il est possible d'obtenir des gels par traitement avec un alcool dont la concentration sera supérieure à 20% (V/V). Si la concentration en alcool est supérieure à 40% il y a coagulation sans formation de gel. La fermeté du gel dépend de la nature de l'alcool, plus ce dernier est hydrophobe plus le gel est ferme.
Les gels de glycinine sont plus fermes que ceux obtenus avec la β conglycinine. Ceci est du au fait que la glycinine renferme des ponts disulfure contrairement à la β conglycinine où il n'y a pas de possibilité de stabilisation par ponts disulfure intercaténaires.
L'acidification ou l'addition de sels de calcium à des solutions de protéines de soja entraîne la formation d'un « caillé » protéique dont la fermeté est moins grande que les gels obtenus par chauffage mais ils sont plus élastiques. Ces « caillés » soumis à un traitement thermique acquièrent les propriétés des gels.






