Les gluténines
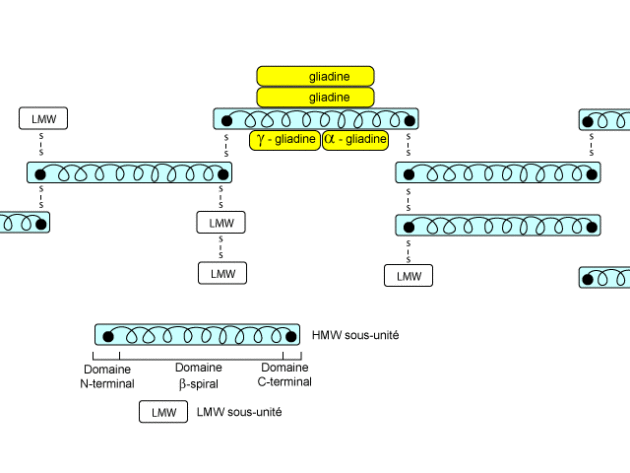
Les gluténines sont insolubles dans l'eau mais solubles dans des solutions acides ou basiques ou en présence d'agents chaotropiques. Elles possèdent une forme allongée (5000 Å x 17,5 Å) et une composition qui diffère de celle des prolamines. Ces molécules polymériques sont caractérisées par des masses moléculaires importantes 500 kDa à 10000 kDa. On distingue deux classes de gluténines. La première qui représente 20% des protéines du gluten donnent après réduction des sous-unités de structure analogue aux gliadines de haut poids moléculaire : ce sont les LMW-GS où 6 résidus cystéine se trouvent au niveau du domaine C-terminal et donnent autant de ponts disulfure intracaténaires et 2 résidus de cystéine supplémentaires qui ne peuvent donner pour des raisons d'encombrement stérique que des ponts intercaténaires. La deuxième classe représente les HMW-GS (10% des protéines du gluten) et peuvent être rassemblées en deux classes les κ et γ HMW-GS.
Voir tableau :
Remarque :
On peut caractériser 3 domaines pour ces molécules : un domaine N-terminal non répétitif de 80 à 100 résidus, un domaine central répétitif de 400 à 700 résidus et un domaine C-terminal d'une quarantaine de résidus. Les domaines N et C-terminal renferment de nombreux acides aminés chargés et la quasi-totalité des acides aminés soufrés. Le domaine répétitif est constitué par la répétition d'un hexapeptide (QQPGQG) dans lequelle viendra s'insérer un hexapeptide (YYPTSP) et un tripeptide (QQP ou QPG). Les différences entre κ et γ HMW-GS résident au niveau des parties N-terminal et partie répétitive ainsi qu'au niveau du nombre de résidus de cystéine (4 dans la κ HMWGS dont 3 en N-terminal et un en C-terminal ; et dans la γ HMW GS 4 résidus en N-terminal et 1 résidu dans la partie répétitive et le domaine C-terminal). Au point de vue de la structure secondaire on met en évidence que le domaine répétitif est constitué par de nombreux coudes béta inverses entraînant la formation d'une spirale qui confère les propriétés élastiques du gluten. Les domaines N et C-terminal sont sous forme globulaire et renferment des hélices alpha.
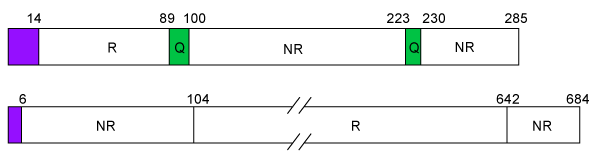
N : domaine à séquence répétitive, NR : domaine à séquence non répétitive, Q : domaine à polyglutamine. A- Gluténine de faible poids moléculaire, B- Gluténine de haut poids moléculaire
Fondamental :
Les gluténines sont responsables de l'élasticité des pâtes boulangères.
Plusieurs modèles structuraux ont été imaginés pour expliquer les propriétés fonctionnelles des gluténines.
Le premier modèle proposé est celui de Ewart qui fait intervenir des sous-unités de masse moléculaire voisine de 45 kDa renfermant au minimum 4 cystéines qui donneront des ponts disulfure intra et intercaténaire. Il est possible avec ce modèle d'expliquer l'élasticité du gluten par la cassure des ponts disulfure entraînant un allongement de la molécule et la reformation des ponts qui permet un retour à la forme initiale.
Un autre modèle proposé par Kasarda fait intervenir à la fois des interactions hydrophobes comme dans les gliadines et covalentes. La rupture des ponts disulfure entraîne, dans ce modèle un effondrement de la conformation et ne permet plus de revenir dans la conformation initiale.
Le dernier modèle proposé, celui de Bushuk prend en considération les deux modèles précédents. Les HMW-GS sont associées par des ponts disulfure et les LMW-GS sont associées aux HMW-GS par interactions hydrophobes. Sur cet ensemble vient s'associer les gliadines par des liaisons faible énergie.