Action des enzymes
De nombreux systèmes enzymatiques sont susceptibles d'entraîner la modification de la structure des caséines.
Fondamental :
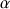 -Action de la chymosine : c'est une enzyme (EC 3.4.23.4) encore dénommée présure qui est utilisée dans la coagulation du lait pour le secteur fromager. La chymosine est une protéase qui est obtenue à partir de la quatrième poche (abomassum ou caillette) de l'estomac des ruminants (polygastriques) dans les premières semaines après la naissance des animaux non sevrés.
-Action de la chymosine : c'est une enzyme (EC 3.4.23.4) encore dénommée présure qui est utilisée dans la coagulation du lait pour le secteur fromager. La chymosine est une protéase qui est obtenue à partir de la quatrième poche (abomassum ou caillette) de l'estomac des ruminants (polygastriques) dans les premières semaines après la naissance des animaux non sevrés.
Cette chymosyne est en présence de pepsine mais dans des rapports qui vont varier selon l'âge et l'alimentation. Chez le veau allaité, le rapport chymosine/pepsine est voisin de 1,4 alors que chez le bovin adulte ce rapport est inférieur à 0,15. Dans ce dernier cas on caractérise surtout de la pepsine A et C (EC 3.4.23.1). Pour le secteur fromager, on préfère l'utilisation de la chymosine par rapport à la pepsine car elle entraîne moins de protéolyse donc moins de peptides amers. Cette chymosine devient une denrée rare car il y a diminution des élevages de veaux traditionnels et une augmentation de la production des fromages. On a tenté dans un premier temps de remplacer la chymosine par des enzymes provenant de micro-organismes. La réactivité des enzymes a été comparée en prenant comme référence la chaîne B de l'insuline constituée de 30 résidus d'acides aminés.
La qualité des produits obtenus avec les enzymes microbiennes a été améliorée, au début les fromages obtenus présentaient des amertumes importantes dues essentiellement à la présence d'estérase qui accompagnaient les protéases. La sélection des souches a permis d'améliorer la qualité mais les produits obtenus à la chymosine restent les plus appréciés. La deuxième possibilité de produire la chymosine est de recourir aux techniques de la biologie moléculaire et produire une chymosine recombinante. L'avantage d'un tel système c'est que la chymosine produite est absolument dépourvue de pepsine et les propriétés enzymatiques sont exactement les mêmes. On obtient un produit de haute qualité avec un prix stable ce qui est appréciable en industries alimentaires.
Méthode :
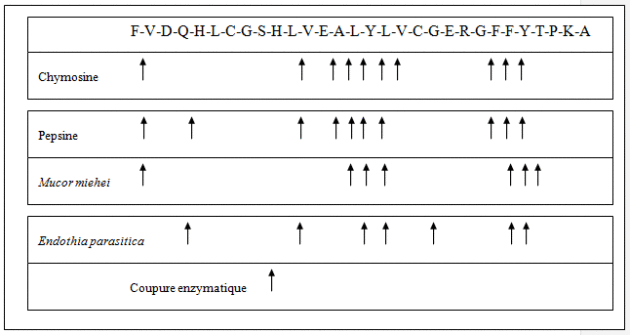
La chymosine est produite dans Aspergillus niger var awamori qui présente les propriétés suivantes : c'est un micro-organisme qui est inscrit sur la liste positive (GRAS) et qui peut excréter dans le milieu de fermentation, après induction par le maltose ou l'isomaltose, des quantités importantes (jusqu'à 50g par litre) d'une enzyme : la glucoamylase. La stratégie de clonage dans A. niger est la suivante : fusion du gène de la prochymosine B (différence entre prochymosine A et B : remplacement du Gly (A) 290 par un Asp (B) et activité spécifique plus faible pour la B mais stabilité plus grande) avec celui de la glucoamylase qui possède les éléments de contrôle de la transcription, de la translation et de la sécrétion chez A. niger et expression d'une protéine chimérique possédant les deux activités.
Pour réaliser ce travail, il est nécessaire de définir une souche hôte de la chymosine avec marqueur de transformation. A. niger est muté une première fois par traitement aux rayons ultraviolet. La mutation porte sur le gène pyrG qui rend le micro-organisme auxotrophe vis-à-vis de l'uridine. Cette souche uridine est à nouveau mutée par traitement chimique au niveau du gène ArgB ce qui la rend doublement auxotrophe vis-à-vis de l'uridine et de l'arginine.
Les souches uridine- et arginine – sont traitées de telle manière que le micro-organisme ne puisse plus exprimer son activité d'aspergillopepsine qui dégrade la chymosine ou qui produit des peptides amers. La séquence d'ADN encodant pour l'aspergillopepsine est remplacée par le gène ArgB provenant d'Aspergillus nidulans. On récupère des transformants qui n'expriment plus l'aspergillopepsine mais qui ont récupéré la faculté de pouvoir croître sur un milieu sans arginine.
La phase suivante consiste à construire un vecteur pGAMpR. L'ADNc de la prochymosine B est inséré dans le plasmide au niveau des derniers codons du gène de la glucoamylase d'A. niger. Le marqueur de sélection sera l'introduction du gène pyr 4 de Neurospora crassa qui lève l'auxotrophie à l'uridine. On recherchera les clones capables de se développer sans la présence d'uridine et d'arginine et exprimant une activité chymosine. Il y a possibilité d'amplifier la réponse, d'augmenter le nombre de copies.
La production obtenue n'est pas une chimère Glucoamylase-prochymosine B mais deux entités parfaitement définies sous forme mature. Cela sous-entend que la protéine de fusion a subi, in vivo, une étape de maturation séparant la glucoamylase de la prochymosine B et l'activation de cette dernière (passage de prochymosine à chymosine soit par autocatalyse soit par d'autres protéases d'A. niger). Le recouvrement de la chymosine s'effectue (après une fermentation en profondeur et la destruction des cellules par un traitement acide et agitation d'une heure) par une filtration qui sera suivie par un protocole de purification (chromatographie hydrophobe ou extraction Liquide-Liquide).
Fondamental :
Le mécanisme d'action de la chymosine est le suivant : l'attaque de la chymosine se fait essentiellement au niveau des acides aminés volumineux et hydrophobes (Phé, Leu, Tyr). Les acides aminés placés de part et d'autre des liaisons peptidiques coupées vont influer sur la vitesse d'hydrolyse. La chymosine va déstructurer la micelle de caséine en intervenant plus spécifiquement au niveau de la caséine kappa qui joue le rôle de colloïde protecteur et produire une coagulation des protéines du lait. On peut distinguer trois phases dans la coagulation :
La première consiste en une coupure spécifique de la caséine kappa au niveau de la liaison peptidique entre la phénylalanine 105 et la méthionine 106. Cette coupure est indépendante de la concentration en calcium et de la température. Cette hydrolyse se traduit par la libération d'un peptide de 65 résidus d'acides aminés renfermant 25% des acides aminés hydroxylés (sérine, thréonine) et ne renfermant pas de cystéine, de phénylalanine, de tyrosine, de tryptophane, d'histidine et d'arginine. Ce caséinoglycomacropeptide (partie C-terminal) possède un haut pouvoir de solvatation. L'autre fragment d'hydrolyse est la paracaséine (partie N-terminal), elle renferme 105 résidus d'acides aminés. Ce fragment reste accroché à la caséine alpha.
La deuxième phase consiste en une réaction de coagulation qui dépend de la concentration en ions calcium et de la température. La vitesse d'agrégation est maximale à 40°C.
La troisième phase consiste en la séparation du caillé et du lactosérum.

La chymosine va entraîner d'autres coupures au niveau des autres molécules de caséines et plus particulièrement entre Phé23 et Phé24 et Phé 24 et Val25 de la caséine αS1 et entre Leu192 et Tyr193 (peptide très amer) et Ala189 et Phé190 de la caséine β.
En fromagerie seuls les fromages obtenus après coagulation par la chymosine peuvent prétendre à l'AOC. Les mélanges de chymosine et de pepsine diminuent les temps d'affinage des fromages.
Remarque :
β-Action des autres protéases : les protéases classiques pepsine, trypsine, chymotrypsine et celles utilisées dans les procédés industriels soit sous forme libre soit intégrées dans des micro-organismes sont susceptibles de réagir sur les caséines non seulement au niveau du tractus digestif pour fournir des nutriments mais elles peuvent être employées pour produire des peptides possédant une activité biologique. On pourra distinguer l'obtention de peptides neuroactifs : les exorphines. Ce sont des peptides qui réagiront au niveau des récepteurs opiacés et entraîneront des effets analgésiques, agiront sur la motricité et les échanges intestinaux et auront une action sur le système nerveux central et périphérique. Ces peptides ont été caractérisés dans la caséine α S1
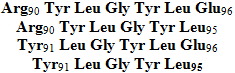
et la caséine β
par action de la pepsine ou de protéases diverses. La caséine kappa va donner par protéolyse des peptides antagonistes des premiers, ce sont des casoxine obtenus par action de la pepsine ou de la trypsine. Ils sont du type :
Il est aussi possible de trouver des peptides ayant une action hypotensive (anti-hypertensive). L'enzyme responsable de l'hypertension est l'enzyme de conversion de l'angiotensine (ACE). L'angiotensine I est transformée en en angiotensine II (le plus puissant des vasoconstricteurs) par élimination du dipeptide C-terminal. Les molécules inhibitrices de cette enzyme possèdent toutes des séquences riches en proline.
D'autres peptides peuvent avoir des activités anti-thrombotiques. Ces peptides ont la particularité de se fixer aux récepteurs plaquettaires et d'empêcher ainsi la formation du caillot. On remarque une homologie de séquence entre un fragment de la caséine kappa et celui de la chaîne gamma du fibrinogène (séquence d'acides aminés 400 à 411). Il est à noter que le gène encodant pour la caséine kappa fait partie de la même famille que le gène encodant pour le fibrinogène. Dans la caséine kappa la partie réactive se trouve dans le caséinoglycomacropeptide et plus particulièrement dans le peptide Met106 – Lys 116
Certains peptides peuvent aussi présenter des activités immunomodulantes en agissant sur le système immunitaire spécifique et non spécifique. Ainsi les β casomorphines sont susceptibles de stimuler la prolifération des lymphocytes des cellules spléniques du rat.
Enfin on peut mettre en évidence des activités vis-à-vis de l'appétit du consommateur par l'intermédiaire des sialo- et asialomacroglycopeptide. Ces structures, ainsi que celles renfermant des phosphosérines seront impliquées dans la biodisponibilité du calcium et du fer. Toutes ces structures ont été caractérisées dans le tractus digestif quand le lait était utilisé comme nutriment.






